Phần I. Câu trắc nghiệm nhiều phương án lựa chọn
Câu 1: Xác định tên gọi của triglyceride
Câu 2: Ký hiệu của amino acid
Câu 3: Khí gây mưa acid
Câu 4: Tính toán khối lượng ester
Câu 5: Tính chất của Adrenaline và Noradrenaline
Câu 6: Tính chất kim loại
Câu 7: Phổ khối lượng
Câu 8: Cân bằng hóa học
Câu 9: Đông tụ protein
Câu 10: Ứng dụng hợp chất vô cơ
Câu 11: Phân loại tơ
Câu 12: Liên kết kim loại
Câu 13: Phản ứng với nước bromine
Câu 14: Liên kết trong NaCl
Câu 15: Phản ứng của acetic acid
Câu 16: Chữa cháy xăng dầu
Câu 17: Sức điện động pin
Câu 18: Khử Fe³⁺ về Fe
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn
Câu 1: Xác định tên gọi của triglyceride
Câu hỏi: Chất X có công thức cấu tạo (C15H31COO)3C3H5. Tên gọi của X là
Phân tích:
Công thức (C15H31COO)3C3H5 cho thấy đây là một triglyceride (triester của glycerol)
Gốc acid béo là C15H31COO-, có 16 carbon (bao gồm carbon của nhóm carbonyl)
Công thức của acid béo là C15H31COOH, đây là palmitic acid (acid palmitic)
Triglyceride được tạo từ 3 phân tử palmitic acid và 1 phân tử glycerol
Đáp án: A. tripalmitin
Câu 2: Ký hiệu của amino acid
Câu hỏi: 2-amino propanoic acid có kí hiệu
Phân tích:
2-amino propanoic acid có công thức: CH3-CH(NH2)-COOH
Đây là alanine, một trong 20 amino acid cơ bản
Ký hiệu quốc tế của alanine là Ala
Đáp án: B. Ala
Câu 3: Khí gây mưa acid
Câu hỏi: Nhóm khí nào sau đây trong không khí khi vượt quá mức cho phép sẽ gây ra hiện tượng mưa acid?
Phân tích:
Mưa acid chủ yếu do các oxide của lưu huỳnh và nitơ
SO2 (sulfur dioxide) tạo H2SO3 và H2SO4 trong nước mưa
NO và NO2 (nitrogen oxides) tạo HNO2 và HNO3 trong nước mưa
Các khí khác như H2, N2O, CO, CH4, N2, NH3, H2S, CO2 không phải là nguyên nhân chính gây mưa acid
Đáp án: B. SO2, NO, NO2
Câu 4: Tính toán khối lượng ester
Câu hỏi: Đun nóng 6,0 gam acetic acid với 5,75 gam ethyl alcohol có H2SO4 đặc làm xúc tác. Khối lượng ester tạo thành khi hiệu suất phản ứng 80% là
Phân tích:
Phản ứng: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O
Khối lượng phân tử: CH3COOH = 60 g/mol, C2H5OH = 46 g/mol, CH3COOC2H5 = 88 g/mol
Số mol CH3COOH = 6,0/60 = 0,1 mol
Số mol C2H5OH = 5,75/46 = 0,125 mol
CH3COOH là chất phản ứng giới hạn
Số mol ester lý thuyết = 0,1 mol
Khối lượng ester lý thuyết = 0,1 × 88 = 8,8 gam
Khối lượng ester thực tế = 8,8 × 80% = 7,04 gam
Đáp án: A. 7,04 gam
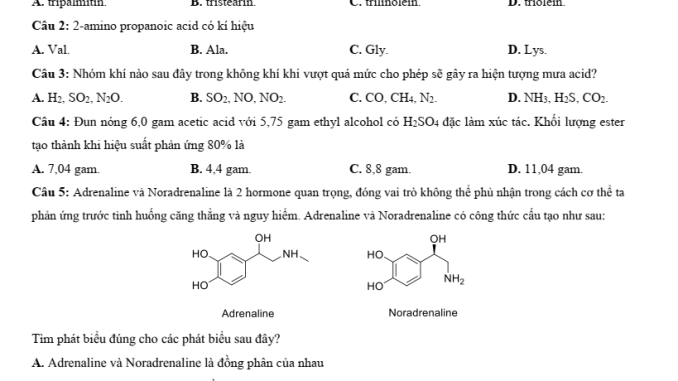
Câu 5: Tính chất của Adrenaline và Noradrenaline
Câu hỏi: Adrenaline và Noradrenaline là 2 hormone quan trọng… Tìm phát biểu đúng
Phân tích:
Cần xem cấu trúc cụ thể từ đề bài để phân tích
Cả hai đều là hợp chất hữu cơ tạp chức (có nhiều nhóm chức khác nhau)
Đều chứa nhóm phenol, nhóm amine và nhóm alcohol
Đáp án: C. Adrenaline và Noradrenaline đều là hợp chất hữu cơ tạp chức
Câu 6: Tính chất kim loại
Câu hỏi: Nhận xét nào sau đây không đúng?
Phân tích:
A. Ag là kim loại dẫn điện tốt nhất – ĐÚNG
B. Kim loại dẫn điện tốt thường dẫn nhiệt tốt – ĐÚNG
C. Ở nhiệt độ thường, các kim loại đều ở trạng thái rắn – SAI (Hg là chất lỏng)
D. Au, Ag, Al, Cu, Sn có tính dẻo cao – ĐÚNG
Đáp án: C. Ở nhiệt độ thường, các kim loại đều ở trạng thái rắn
Câu 7: Phổ khối lượng
Câu hỏi: Cho phổ khối lượng (MS) của một hợp chất hữu cơ X… Chất X có thể là
Phân tích:
Cần phân tích các peak trong phổ MS để xác định cấu trúc
So sánh với khối lượng phân tử của các lựa chọn
Acetic acid: 60, isoamyl acetate: 130, methyl formate: 60, vinyl acetate: 86
Đáp án: A. acetic acid (cần xem phổ cụ thể để xác định chính xác)
Câu 8: Cân bằng hóa học
Câu hỏi: N2(g) + 3H2(g) ⇌ 2NH3(g), ΔrH°298 = -91,8 kJ. Nhận xét nào đúng?
Phân tích:
A. ΔH nhỏ hơn 0 nên phản ứng tỏa nhiệt, không thu nhiệt – SAI
B. Tăng T làm cân bằng dịch chuyển sang trái, giảm NH3, tỉ khối giảm – SAI
C. Ở trạng thái cân bằng, tất cả các chất đều có mặt – ĐÚNG
D. Giảm áp suất làm cân bằng dịch chuyển sang trái (ngược chiều thuận) – SAI
Đáp án: C. Khi phản ứng đạt đến trạng thái cân bằng, hỗn hợp có chứa N2, H2 và NH3
Câu 9: Đông tụ protein
Câu hỏi: Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do
Phân tích:
Riêu cua chủ yếu là protein bị đông tụ
Khi nấu ở nhiệt độ cao, protein bị biến tính và đông tụ
Đây là sự đông tụ do nhiệt độ, không phải do acid hay phản ứng màu
Đáp án: D. sự đông tụ của protein do nhiệt độ
Câu 10: Ứng dụng hợp chất vô cơ
Câu hỏi: Hợp chất vô cơ X có ứng dụng: điều trị dư acid dạ dày, điều chỉnh vị chua nước giải khát, làm tăng độ xốp bánh
Phân tích:
Điều trị dư acid dạ dày: cần chất kiềm yếu
NaHCO3 (sodium bicarbonate) có tất cả các tính chất này
Tác dụng với acid tạo CO2 làm bánh xốp
Đáp án: C. NaHCO3
Câu 11: Phân loại tơ
Câu hỏi: Trong len lông cừu, tơ tằm, tơ capron, tơ nitron, tơ visco có bao nhiêu tơ tổng hợp?
Phân tích:
Len lông cừu: tơ tự nhiên
Tơ tằm: tơ tự nhiên
Tơ capron (nylon): tơ tổng hợp
Tơ nitron (acrylic): tơ tổng hợp
Tơ visco: tơ hóa học (bán tổng hợp)
Đáp án: D. 2
Câu 12: Liên kết kim loại
Câu hỏi: Liên kết giữa cation kim loại và electron hóa trị tự do trong tinh thể kim loại
Phân tích:
Đây là định nghĩa của liên kết kim loại
Electron hóa trị tự do tạo thành “biển electron”
Cation kim loại được giữ bởi lực hút tĩnh điện với biển electron
Đáp án: B. kim loại
Câu 13: Phản ứng với nước bromine
Câu hỏi: Phenol, glucose, fructose, saccharose, maltose, aniline, methyl methacrylate. Có bao nhiêu chất phản ứng với nước bromine?
Phân tích:
Phenol: có phản ứng (thế vào nhân benzene)
Glucose, fructose: có phản ứng (nhóm aldehyde, ketone)
Saccharose: không có phản ứng
Maltose: có phản ứng (có nhóm aldehyde tự do)
Aniline: có phản ứng (thế vào nhân benzene)
Methyl methacrylate: có phản ứng (liên kết đôi C=C)
Đáp án: A. 5
Câu 14: Liên kết trong NaCl
Câu hỏi: Trong hợp chất sodium chloride có liên kết
Phân tích:
Na (Z=11): [Ne]3s¹, dễ mất 1e tạo Na⁺
Cl (Z=17): [Ne]3s²3p⁵, dễ nhận 1e tạo Cl⁻
Liên kết giữa Na⁺ và Cl⁻ là liên kết ion
Đáp án: B. ion
Câu 15: Phản ứng của acetic acid
Câu hỏi: Acetic acid không phản ứng được với chất nào?
Phân tích:
CH3COOH + NH3 → CH3COONH4 (có phản ứng)
CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O (có phản ứng)
CH3COOH + Na2SO4 → không phản ứng (muối của acid mạnh hơn)
2CH3COOH + 2Na → 2CH3COONa + H2 (có phản ứng)
Đáp án: C. Na2SO4
Câu 16: Chữa cháy xăng dầu
Câu hỏi: Phân tích các phát biểu về việc dùng cát/MAP thay vì nước để chữa cháy xăng dầu
Phân tích:
(a) Xăng dầu nhẹ hơn nước, không tan, sẽ nổi lên – ĐÚNG
(b) Cát/MAP tạo lớp phủ ngăn tiếp xúc với O2 – ĐÚNG
(c) Nước bay hơi là quá trình thu nhiệt, không tỏa nhiệt – SAI
(d) Cát/MAP hấp thụ nhiệt làm giảm nhiệt độ – ĐÚNG
Đáp án: D. (a), (b), (d)
Câu 17: Sức điện động pin
Câu hỏi: Pin có sức điện động chuẩn 1,562V từ bảng thế điện cực
Phân tích:
Từ bảng thế điện cực chuẩn:
Al³⁺/Al: -1,676V; Zn²⁺/Zn: -0,763V; Fe²⁺/Fe: -0,440V; Cu²⁺/Cu: 0,340V; Ag⁺/Ag: 0,799V
E°pin = E°cathode – E°anode
Zn-Ag: E° = 0,799 – (-0,763) = 1,562V
Đáp án: A. Zn – Ag
Câu 18: Khử Fe³⁺ về Fe
Câu hỏi: Có bao nhiêu kim loại có thể khử Fe³⁺ về Fe?
Phân tích:
Để khử Fe³⁺ về Fe, cần E°(M^n+/M) nhỏ hơn E°(Fe³⁺/Fe²⁺) = 0,771V
Các kim loại có E° nhỏ hơn 0,771V: Al (-1,676V), Zn (-0,763V), Fe (-0,440V)
Nhưng Fe không thể tự khử chính nó
Chỉ có Al và Zn có thể khử Fe³⁺
Đáp án: A. 2
Phần II. Câu trắc nghiệm đúng sai
Câu 19: Ăn mòn hóa học và ăn mòn điện hóa
Câu 20: Ứng dụng điện phân
Câu 21: Vật liệu polymer
Câu 22: Triglyceride X
Phần II. Câu trắc nghiệm đúng sai
Câu 19: Ăn mòn hóa học và ăn mòn điện hóa
Tình huống: Nhúng thanh kẽm và thanh đồng (không tiếp xúc) vào H₂SO₄ loãng, nối bằng dây dẫn có khóa X.
a) Khi chưa đóng khóa X xảy ra ăn mòn hóa học – ĐÚNG
Phân tích:
Khi khóa X mở, hai thanh kim loại không tạo thành mạch điện kín
Ăn mòn hóa học là quá trình oxi hóa-khử trong đó electron của kim loại được chuyển trực tiếp đến các chất trong môi trường, không xuất hiện dòng điện
Cả Zn và Cu đều phản ứng riêng rẽ với H₂SO₄ loãng theo cơ chế ăn mòn hóa học
b) Khi đóng khóa X, xảy ra ăn mòn điện hóa và thanh Zn bị ăn mòn – ĐÚNG
Phân tích:
Khi đóng khóa X, tạo thành pin điện hóa với Zn làm cực âm, Cu làm cực dương
Ăn mòn điện hóa là quá trình kim loại bị ăn mòn do tác dụng của dung dịch điện ly và tạo dòng điện
Zn có thế điện cực âm hơn Cu nên bị oxi hóa: Zn → Zn²⁺ + 2e⁻
c) Tốc độ bọt khí thoát ra khi mở và đóng khóa X như nhau – SAI
Phân tích:
Khi mở khóa X: ăn mòn hóa học xảy ra chậm
Khi đóng khóa X: ăn mòn điện hóa xảy ra nhanh hơn ăn mòn hóa học
Tốc độ thoát khí H₂ khi đóng khóa X sẽ lớn hơn khi mở khóa X
d) Khi thay Cu bằng Mg, thanh Zn vẫn bị ăn mòn điện hóa – SAI
Phân tích:
Mg có thế điện cực âm hơn Zn (-2,37V so với -0,76V)
Khi thay Cu bằng Mg, Mg sẽ trở thành cực âm và bị ăn mòn
Zn trở thành cực dương và được bảo vệ
Câu 20: Ứng dụng điện phân
a) Tính toán thời gian mạ điện Cu – ĐÚNG
Phân tích tính toán:
Thể tích lớp Cu cần mạ: V = 2πrh × d = 2 × 3,14 × 1,7 × 10 × 0,02 = 2,1352 cm³
Khối lượng Cu cần mạ: m = V × ρ = 2,1352 × 8,96 = 19,13 g
Phương trình: Cu²⁺ + 2e⁻ → Cu
Số mol electron cần: n(e⁻) = 2 × (19,13/63,5) = 0,6024 mol
Thời gian: t = (n × F)/I = (0,6024 × 96500)/6 = 9686 s = 4,12 giờ
b) Điện phân NaCl không màng ngăn thu được nước Javel và H₂ – ĐÚNG
Phân tích:
Điện phân NaCl có màng ngăn: 2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂
Không có màng ngăn: Cl₂ + 2NaOH → NaCl + NaClO + H₂O
Phương trình tổng: NaCl + H₂O → NaClO + H₂
Sản phẩm thu được là nước Javel (NaClO) và khí H₂
c) Tinh luyện Cu: Cu không tinh khiết ở cathode – SAI
Phân tích:
Trong tinh luyện Cu bằng điện phân:
Cu không tinh khiết phải nối vào anode (cực dương)
Cu tinh khiết nối vào cathode (cực âm)
Ở anode: Cu không tinh khiết bị oxi hóa tan ra
Ở cathode: Cu²⁺ bị khử tạo Cu tinh khiết
d) Tính toán sản xuất Al từ bauxite – ĐÚNG
Phân tích tính toán:
Khối lượng Al₂O₃ cần: 400 kg Al × (102/54) = 755,6 kg Al₂O₃
Với hiệu suất 85%: Al₂O₃ thực tế = 755,6/0,85 = 889 kg
Khối lượng bauxite: 889/(0,52) = 1709,4 kg ≈ 1,7094 tấn
Câu 21: Vật liệu polymer
a) Trùng hợp buta-1,3-diene có cấu trúc tương tự cao su tự nhiên – SAI
Phân tích:
Cao su tự nhiên là polymer của isoprene với kiểu 1,4 và 100% cấu hình cis
Trùng hợp buta-1,3-diene thu được cao su có cấu hình cả cis và trans (kiểu 1,4), ngoài ra còn có nhánh vinyl do trùng hợp kiểu 1,2
b) Khác biệt giữa trùng hợp và trùng ngưng – ĐÚNG
Phân tích:
Phản ứng trùng ngưng có tạo ra các phân tử nhỏ (như H₂O, HCl)
Phản ứng trùng hợp không tạo ra các phân tử nhỏ
Đây là sự khác biệt cơ bản giữa hai loại phản ứng tạo polymer
c) Tính toán sản xuất poly(vinyl acetate) – ĐÚNG
Phân tích tính toán:
Khối lượng poly(vinyl acetate) trong keo dán: 80% × 8,6 = 6,88 kg
Với hiệu suất 80%: khối lượng vinyl acetate cần = 6,88/0,8 = 8,6 kg
d) Nylon-6,6 được điều chế từ phản ứng trùng ngưng – ĐÚNG
Phân tích:
Nylon-6,6 được tạo từ phản ứng giữa hexamethylenediamine và adipic acid
Đây là phản ứng trùng ngưng với việc tách phân tử H₂O
Câu 22: Triglyceride X
a) Công thức phân tử của X là C₅₇H₉₈O₆
Phương pháp tính:
Công thức tổng quát triglyceride: Glycerol + 3 acid béo – 3H₂O
Cần đếm chính xác số nguyên tử C, H, O từ cấu trúc
Phân tích chi tiết:
Khung glycerol: C₃H₅O₃
Từ hình ảnh, đếm được khoảng 18 carbon cho mỗi chuỗi acid béo
Tổng carbon ≈ 3 + (3×18) = 57 carbon
Tính số hydrogen dựa trên độ bão hòa và số liên kết đôi
Kết luận: ĐÚNG – Công thức C₅₇H₉₈O₆ phù hợp với cấu trúc triglyceride có 3 chuỗi acid béo 18 carbon
b) Acid béo ở vị trí (2) thuộc loại acid béo omega-9
Khái niệm omega-9:
Omega-9 có liên kết đôi ở vị trí carbon thứ 9 tính từ nhóm methyl cuối (omega)
Acid oleic là omega-9 phổ biến nhất, có 1 liên kết đôi
Phân tích chuỗi (2):
Có 1 liên kết đôi duy nhất
Vị trí liên kết đôi từ hình ảnh tương ứng với vị trí thứ 9 từ đầu omega
Cấu trúc phù hợp với acid oleic (C18:1 ω-9)
Kết luận: ĐÚNG – Chuỗi (2) là acid béo omega-9
c) Các gốc của acid béo không no trong phân tử X đều có cấu hình cis-
Phân biệt cis và trans:
Cis: Các nguyên tử hydrogen ở cùng phía liên kết đôi
Trans: Các nguyên tử hydrogen ở hai phía khác nhau của liên kết đôi
Đặc điểm cấu trúc:
Cis tạo “khúc cong” trong phân tử, thường ở dạng lỏng
Trans có cấu trúc thẳng, thường ở dạng rắn
Acid béo tự nhiên chủ yếu có cấu hình cis
Phân tích từ hình ảnh:
Các liên kết đôi trong chuỗi (2) và (3) đều thể hiện cấu hình cis
Tạo độ cong đặc trưng trong cấu trúc phân tử
Kết luận: ĐÚNG – Tất cả liên kết đôi đều có cấu hình cis
d) Hydro hóa hoàn toàn 427 kg X thu được 432 kg chất béo rắn
Phương trình phản ứng:
C=C + H₂ → C-C-C (ở nhiệt độ cao, áp suất cao, xúc tác)
Mỗi liên kết đôi tiêu thụ 1 phân tử H₂ (2g)
Tính toán khối lượng:
Khối lượng tăng = 432 – 427 = 5 kg = 5000 g
Số mol H₂ tiêu thụ = 5000g ÷ 2g/mol = 2500 mol
Phân tích số liên kết đôi:
Chuỗi (1): 0 liên kết đôi
Chuỗi (2): 1 liên kết đôi
Chuỗi (3): khoảng 4-5 liên kết đôi (từ hình ảnh)
Tổng: khoảng 5-6 liên kết đôi/phân tử
Kiểm tra:
Khối lượng phân tử X ≈ 882 g/mol (từ C₅₇H₉₈O₆)
Số mol X = 427000g ÷ 882g/mol ≈ 484 mol
Số liên kết đôi cần = 2500 ÷ 484 ≈ 5.2 liên kết đôi/phân tử
Kết luận: ĐÚNG – Phù hợp với tính toán stoichiometry
Phần III. Câu trắc nghiệm trả lời ngắn
Câu 23: Xác định nồng độ Ca²⁺ trong máu
Câu 24: Xác định số công thức cấu tạo α-amino acid
Câu 25: Nhiệt độ sôi của methyl formate
Câu 26: Số công thức cấu tạo amine bậc hai đơn chức
Câu 27: Số nhóm -OH trong saccharose
Câu 28: Tính khối lượng CaO làm nóng coffee
Phần III. Câu trắc nghiệm trả lời ngắn
Câu 23: Xác định nồng độ Ca²⁺ trong máu
Bài toán: Calcium oxalate kết tủa từ 1 mL máu tác dụng vừa hết với 2 mL dung dịch KMnO₄ 5×10⁻⁴M. Xác định nồng độ Ca²⁺ (mg/100 mL máu).
Phân tích và giải:
Cân bằng phương trình phản ứng:
2KMnO₄ + 5CaC₂O₄ + 8H₂SO₄ → 2MnSO₄ + 5CaSO₄ + K₂SO₄ + 10CO₂ + 8H₂O
Tính toán:
Số mol KMnO₄ phản ứng: n = C × V = 5×10⁻⁴ × 0,002 = 1×10⁻⁶ mol
Theo phương trình: 2 mol KMnO₄ ≡ 5 mol CaC₂O₄
Số mol CaC₂O₄ = (5/2) × 1×10⁻⁶ = 2,5×10⁻⁶ mol
Số mol Ca²⁺ = 2,5×10⁻⁶ mol (từ 1 mL máu)
Tính nồng độ trong 100 mL máu:
Khối lượng Ca²⁺ trong 100 mL = 2,5×10⁻⁶ × 40 × 10³ × 100 = 10 mg
Đáp án: 10 mg Ca²⁺/100 mL máu
Câu 24: Xác định số công thức cấu tạo α-amino acid
Dữ liệu: %C = 46,60%; %H = 8,74%; %N = 13,59%; M = 103 g/mol
Phân tích và giải:
Xác định công thức phân tử:
Số nguyên tử C: (103 × 46,60%)/12 = 4
Số nguyên tử H: (103 × 8,74%)/1 = 9
Số nguyên tử N: (103 × 13,59%)/14 = 1
Số nguyên tử O: (103 – 48 – 9 – 14)/16 = 2
Công thức phân tử: C₄H₉O₂N
Các α-amino acid có thể có:
NH₂-CH(CH₃)-CH₂-COOH (2-aminobutanoic acid)
NH₂-CH(C₂H₅)-COOH (2-aminobutanoic acid – đồng phân khác)
NH₂-CH₂-CH(CH₃)-CH₂-COOH (3-amino-2-methylpropanoic acid)
NH₂-CH₂-CH₂-CH(CH₃)-COOH (4-aminopentanoic acid)
Đáp án: 4 công thức cấu tạo
Câu 25: Nhiệt độ sôi của methyl formate
Cho các chất: Methylamine, propan-1-ol, methyl formate, acetic acid với nhiệt độ sôi: 118,0°C; 97,0°C; -6,4°C; 32,0°C
Phân tích và giải:
Xác định nhiệt độ sôi dựa trên liên kết hydrogen:
Acetic acid (CH₃COOH): có liên kết hydrogen mạnh → 118,0°C
Propan-1-ol (C₃H₇OH): có liên kết hydrogen → 97,0°C
Methyl formate (HCOOCH₃): không có liên kết hydrogen, khối lượng phân tử trung bình → 32,0°C
Methylamine (CH₃NH₂): khối lượng phân tử nhỏ → -6,4°C
Đáp án: 32,0°C
Câu 26: Số công thức cấu tạo amine bậc hai đơn chức
Dữ liệu: 7,3 gam amine X + HCl → 10,95 gam muối
Phân tích và giải:
Tính khối lượng phân tử amine:
Khối lượng HCl phản ứng: 10,95 – 7,3 = 3,65 gam
Số mol HCl = 3,65/36,5 = 0,1 mol
Số mol amine = 0,1 mol (tỉ lệ 1:1)
Khối lượng phân tử amine: M = 7,3/0,1 = 73 g/mol
Công thức phân tử: C₄H₁₁N
Các amine bậc hai có thể có:
(CH₃)₂NCH₂CH₃
CH₃NHCH₂CH₂CH₃
CH₃NHCH(CH₃)₂
Đáp án: 3 công thức cấu tạo
Câu 27: Số nhóm -OH trong saccharose
Phân tích và giải:
Cấu trúc saccharose:
Saccharose được tạo bởi α-glucose và β-fructose liên kết α-1,2-glycoside
Glucose có 5 nhóm -OH, fructose có 5 nhóm -OH
Liên kết glycoside loại bỏ 2 nhóm -OH (một từ mỗi đơn vị)
Tính toán:
Tổng nhóm -OH ban đầu: 5 + 5 = 10
Số nhóm -OH bị loại bỏ khi tạo liên kết: 2
Số nhóm -OH còn lại: 10 – 2 = 8
Đáp án: 8 nhóm -OH
Câu 28: Tính khối lượng CaO làm nóng coffee
Dữ liệu: 210 mL coffee, từ 10°C → 40°C, hiệu suất 80%, ΔfH°: CaO (-635), H₂O (-286), Ca(OH)₂ (-985) kJ/mol
Phân tích và giải:
Phương trình phản ứng:
CaO + H₂O → Ca(OH)₂
Tính nhiệt phản ứng:
ΔrH° = ΔfH°[Ca(OH)₂] – ΔfH°[CaO] – ΔfH°[H₂O]
ΔrH° = -985 – (-635) – (-286) = -64 kJ/mol
Tính nhiệt cần thiết:
Khối lượng coffee: 210 mL × 1 g/mL = 210 g
Nhiệt cần thiết: Q = m × c × ΔT = 210 × 4,18 × (40-10) = 26.334 J = 26,334 kJ
Nhiệt cần cung cấp (hiệu suất 80%): 26,334/0,8 = 32,918 kJ
Tính khối lượng CaO:
Số mol CaO cần: 32,918/64 = 0,514 mol
Khối lượng CaO: 0,514 × 56 = 28,8 g ≈ 29 g
Đáp án: 29 gam









